X115
® +PLUS
3 | Complesso Nutraceutico Bifasico | Con 3 Fonti di Collagene Idrolizzato, Acido Ialuronico, Condroitina,
Astaxantina, Coenzima Q10 ,
Acido Lipoico ,
Resveratrolo ed Estratti Biostimolanti - Antiossidanti (Melograno, Cacao, Olivo, Centella, Echinacea).
Queste teorie sono incentrate sugli aspetti genetici dell’invecchiamento.
In pratica, l’invecchiamento sarebbe il frutto di un calendario biologico predeterminato , come se il corpo umano fosse progettato per nascere, crescere e invecchiare.
A tale scopo, si ipotizza che col trascorrere degli anni si inneschino dei cambiamenti nell’espressione genica che influenzano i sistemi responsabili delle risposte di crescita, riparazione e morte cellulare.
Inoltre, si ritiene che l’organismo sia geneticamente predeterminato a invecchiare perché una durata di vita limitata si traduce in benefici evolutivi per la specie 11
Le teorie dell’invecchiamento programmato si possono suddividere in ulteriori sottocategorie.
L’invecchiamento sarebbe il risultato di un’attivazione e disattivazione sequenziale di determinati “geni dell’invecchiamento” durante il corso della vita 2
Invecchiamento Cellulare e Accorciamento dei Telomeri
L’idea generale dietro questa ipotesi è che le cellule umane possano replicarsi solo un numero finito di volte prima di diventare senescenti.
La maggior parte dei sostenitori di questa teoria fa riferimento all’accorciamento dei telomeri 12
I telomeri sono sequenze di DNA ripetute presenti alle estremità dei cromosomi. Non potendo essere completamente replicati dalle DNA polimerasi, i telomeri si accorciano a ogni divisione cellulare 13
L’accorciamento dei telomeri potrebbe essere un “orologio” che alla fine impedisce alle cellule di dividersi ulteriormente e le rende più suscettibili al danno cellulare. Infatti, i telomeri sembrano svolgere anche un ruolo di protezione dei cromosomi 14
I telomeri corti sono stati collegati a malattie degenerative e invecchiamento precoce negli esseri umani. Pertanto, molti ricercatori hanno tentato di scoprire se l’attivazione della telomerasi e l’allungamento dei telomeri possano prevenire o ritardare l’invecchiamento nell’uomo e negli animali 15 , 16 , 17
Purtroppo, anche questa teoria non è del tutto convincente 18 , 19
Secondo questa teoria, gli ormoni svolgerebbero un ruolo chiave per controllare il ritmo dell’invecchiamento 20
Poiché i livelli di ormoni – come l’ormone della crescita (GH) e il fattore di crescita insulino-simile I (IGF-1 ) – diminuiscono con l’età, l’idea che tali cambiamenti causino l’invecchiamento è stata suggerita alcuni decenni fa.
Più recentemente i ricercatori si sono concentrati sul ruolo di regolatore endocrino dell’ipotalamo (invecchiamento neuro-endocrino) e su altri ormoni come DHEA (deidroepiandrosterone) e melatonina .
Questa teoria si basa sui cambiamenti sfavorevoli nelle funzioni immunitarie che avvengono con l’invecchiamento.
Ad esempio, man mano che si invecchia, gli anticorpi perdono la loro efficacia e l’organismo può combattere meno efficacemente infezioni e malattie 21
In effetti, la risposta immunitaria disregolata è stata collegata a malattie cardiovascolari, infiammazione, morbo di Alzheimer e cancro 22
Infiammazione e Invecchiamento
Di pari passo all’immunosenescenza, con l’invecchiamento si assiste a un graduale aumento dell’infiammazione. Si instaura così un’infiammazione cronica di basso grado23
L’infiammazione è quindi legata a doppio filo con l’invecchiamento: che ne sia causa o conseguenza, contribuisce sicuramente a peggiorarlo.
SASP è l’acronimo di Senescence-Associated Secretory Phenotype (fenotipo secretorio associato alla senescenza ).
Questo fenomeno biologico consiste nella secrezione elevata di fattori pro-infiammatori e pro-ossidanti da parte delle cellule invecchiate, e rappresenta la causa principale dei loro effetti dannosi.
Di fatto, quindi, lo SASP provoca un’infiammazione sterile (in assenza di infezioni) che può rafforzare e diffondere la senescenza a livello locale e sistemico 24
inibendo la funzione delle cellule staminali ,
interrompendo l’omeostasi dei tessuti per la ridotta rigenerazione cellulare,
aumentando l’infiammazione cronica e lo stress ossidativo , che possono influenzare altre cellule e diffondere la senescenza a quelle vicine.
Si è visto ad esempio che il trapianto di un piccolo numero di cellule senescenti attorno alle articolazioni del ginocchio dei topi induce una condizione simile all’osteoporosi osservata negli anziani 25
Gli scienziati ipotizzano che questa infiammazione “sterile” cronica di basso livello svolga un ruolo in molte diverse malattie dell’invecchiamento tra cui morbo di Alzheimer, malattie cardiache, diabete di tipo 2 e cancro 26 , 27 , 28 , 29
Il limite delle teorie genetiche dell’invecchiamento è che ignorano l’importanza dei fattori esterni.
In effetti, è stato stimato che solo il 25-32% della variazione complessiva della durata della vita adulta può essere attribuita alla variazione genetica 30
A differenza di quelle genetiche, le teorie del danno o dell’errore enfatizzano il ruolo dei fattori ambientali come principale causa dell’invecchiamento.
In particolare, ritengono che sia il normale metabolismo che l’esposizione a fattori esterni (tossine, raggi UV , radiazioni ionizzanti ecc.) produrrebbero un numero di imperfezioni irreversibili nelle molecole cellulari.
In un documento fondamentale pubblicato nel 2013, i ricercatori sulla longevità hanno identificato 9 diversi tipi di danni e disfunzioni cellulari che sospettano siano alla base del processo di invecchiamento, indicati come i “segni distintivi dell’invecchiamento” 4
Esempi di questi danni includono le disfunzioni dei mitocondri (spesso indicati come le centrali elettriche delle cellule), l’accorciamento di “cappucci protettivi” all’estremità dei cromosomi (telomeri) e il danno al DNA 4
Come le teorie genetiche, anche le teorie del danno possono comprendere diverse sottocategorie.
Questa teoria sostiene che le mutazioni genetiche causino il malfunzionamento delle cellule.
In pratica, i danni al DNA si verificano continuamente nelle cellule degli organismi viventi, ma possono anche essere favoriti dal metabolismo stesso e da fattori ambientali.
Mentre la maggior parte di questi danni viene riparata, alcuni si accumulano nel tempo.
Dunque, le mutazioni genetiche si verificano e si accumulano con l’aumentare dell’età, causando il deterioramento e il malfunzionamento delle cellule.
Questa teoria, è una delle più note al grande pubblico.
I radicali liberi sono un normale sottoprodotto del metabolismo ossidativo.
All’interno di limiti fisiologici queste molecole altamente reattive sono fondamentali per la normale attività cellulare 31
Tuttavia, un eccesso di radicali liberi crea numerosi danni biologici, denaturando le proteine e distruggendo i lipidi di membrana, gli acidi nucleici e alcuni organelli come lisosomi e proteosomi 32
L’accumularsi di danni cellulari alla fine causerebbe l’arresto del funzionamento delle cellule, dei tessuti e degli organi 33 , 34
Il corpo possiede alcuni antiossidanti naturali sotto forma di enzimi, che aiutano a frenare il pericoloso accumulo di questi radicali liberi. Tuttavia, in caso di aumentata produzione di radicali liberi, anche il contributo della dieta risulta importante.
Questa ipotesi ormai datata ha lanciato la rincorsa all’uso di integratori antiossidanti, che tuttavia – a parte qualche evidenza positiva nell’aumentare la longevità di piccoli animali – si sono rivelati complessivamente inefficaci nell’uomo (e in alcuni casi addirittura controproducenti).
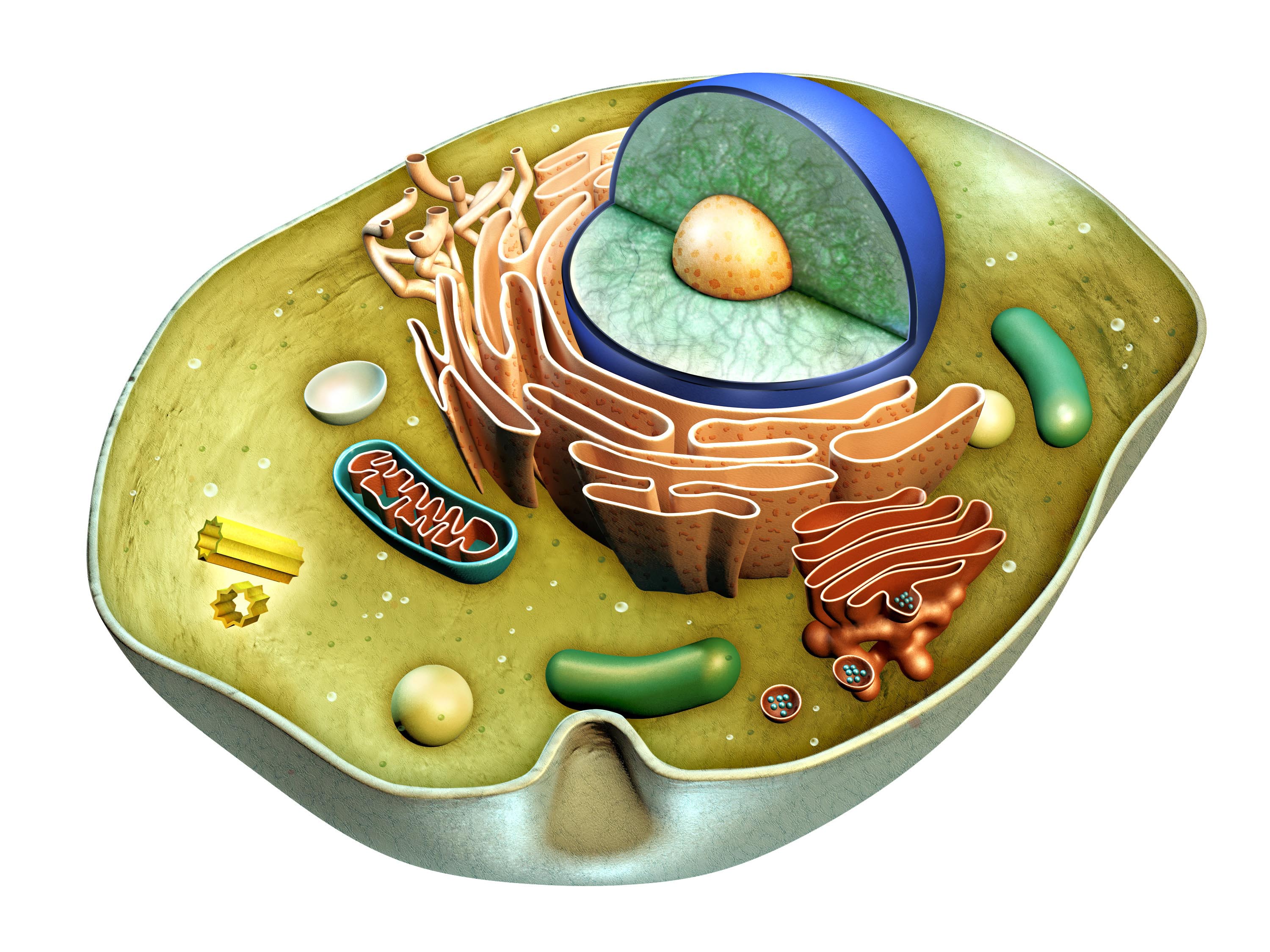
Poiché i mitocondri sono i principali produttori di radicali liberi dell’ossigeno nelle cellule dei mammiferi, il DNA mitocondriale è particolarmente suscettibile al danno ossidativo 35
Man mano che le persone invecchiano, i mitocondri accumulano danni e mutazioni del loro DNA, diventando meno efficienti e producendo meno ATP.
Ciò significa che le cellule hanno meno energia per svolgere funzioni vitali come la rimozione dei rifiuti, la costruzione di proteine e la lotta contro i patogeni 4
Si è visto ad esempio che topi geneticamente modificati per avere mitocondri disfunzionali invecchiano molto più velocemente 36 , 37
I mitocondri disfunzionali e danneggiati vengono costantemente sostituiti con altri sani attraverso un processo noto come biogenesi mitocondriale 4
I sostenitori di questa teoria partono dall’evidenza che maggiore è il tasso metabolico di un organismo, minore sarebbe la sua durata della vita 38
Poiché un metabolismo accelerato è associato a un maggior consumo di ossigeno, quindi a una maggiore sintesi di radicali liberi, questa teoria è intrecciata con quella del danno ossidativo.
Ad esempio, la ricerca mostra che alcuni pesci, quando la temperatura dell’acqua si abbassa, vivono più a lungo delle loro controparti di acqua calda. Anche la restrizione calorica , rallentando il tasso metabolico, sembra offrire analoghi benefici.
Tuttavia, proprio come le altre teorie, anche questa ipotesi non è del tutto adeguata per spiegare la durata massima della vita 39
Secondo questa teoria, nel corso della vita si formerebbero e accumulerebbero degli aggregati di molecole cellulari disfunzionali, ad esempio tra zuccheri e proteine o tra DNA e metalli tossici come l’alluminio.
Questo accumulo di “grovigli molecolari” danneggerebbe la funzione stessa delle proteine, inclusi gli enzimi cellulari, con danno a cellule e tessuti, e conseguente invecchiamento.
Vivere una vita più lunga porta a una maggiore possibilità che si formino questi aggregati disfunzionali, a loro volta coinvolti in problemi come rigidità dei vasi sanguigni, rigidità dei legamenti e tendini muscolari, cataratte, aterosclerosi , e molti altri.
La senescenza cellulare dipenderebbe quindi dall’accumulo di questi rifiuti biologici che non possono essere completamente rimossi dall’organismo.
Esempi sono dati da:
lipofuscina, una sostanza composta da materiale non degradabile che si accumula nei lisosomi, contribuendo a indurre danni cellulari e riducendo la capacità di ripararli;
accumulo di placche aterosclerotiche, ricche di colesterolo ossidato e glicato;
polimeri proteici, come le proteine amiloidi, rifiuti tossici che si accumulano principalmente nel sistema nervoso. Infatti, l’aggregazione proteica è la caratteristica comune che definisce le malattie neurodegenerative associate all’età, come il Parkinson e l’Alzheimer 40
AGEs
In una certa misura, i rifiuti metabolici includono anche le proteine alterate dal legame a uno zucchero, principalmente molecole di glucosio .
AGEs è l’acronimo di Advanced glycation end products (in italiano: prodotti finali della glicazione avanzata ).
I prodotti finali della glicosilazione avanzata si formano quando si verificano reazioni tra gruppi aldeidici di zuccheri riducenti e gruppi amminici di proteine. La formazione di questi prodotti metabolici avviene in modo dipendente dall’elevata glicemia 41
Negli individui che invecchiano, il controllo glicemico diventa meno regolato e la tolleranza al glucosio può subire alterazioni significative. La predominanza dei prodotti finali della glicosilazione avanzata può provocare anomalie come la fibrosi vascolare, l’ispessimento delle membrane basali, l’alterazione del metabolismo lipidico alterato e la ridotta elasticità del collagene .
Inoltre, i prodotti finali della glicosilazione avanzata sono associati all’induzione di risposte infiammatorie, con conseguente rilascio di sostanze infiammatorie e specie reattive dell’ossigeno, causando ulteriori danni ai tessuti 31
Tale processo pregiudica il funzionamento di biomolecole importanti per la salute cellulare.
Secondo questa ipotesi, cellule e tessuti hanno parti vitali che si consumano con l’uso ripetuto.
Proprio come i componenti di un’auto che invecchia, le parti del corpo alla fine si usurerebbero, fino a perdere la capacità di svolgere le loro funzioni.
Da anni si stanno compiendo grandi sforzi per prolungare una vita sana.
Oltre all’indiscutibile importanza di una dieta e uno stile di vita sani, studi preliminari hanno osservato i potenziali benefici antiaging per le seguenti strategie:
restrizione calorica, incluso digiuno intermittente e dieta chetogenica intermittente;
attività fisica regolare;
varie tipologie di integratori (ad es. precursori del NAD+, spermidina , D-glucosamina, acido gallico , fisetina , luteolina , piperlongumina);
integrazione con spermidina o D-glucosamina;
terapia con cellule staminali;
terapie ormonali;
terapie geniche;
farmaci noti o sperimentali (inibitori mTOR , senolitici, acarbosio, clofibrato, metformina, quercetina e dasatinib);
gestione dello stress , tecniche di meditazione, gratificazione, qualità della vita.
Longevità | Come Aumentarla e Vivere Fino a 120 Anni
Un Consiglio per la Tua Bellezza Per la tua routine di bellezza, ti consigliamo il siero viso X115® ACE.
Grazie a una tecnologia brevettata, permette l'Uso delle Vitamine A | C | E | nello Stato più Puro ed Efficace. Per un Trattamento di Bellezza ai Massimi Livelli. Guarda il video per saperne di più.
X115® ACE | Pure Vitamins Antiage Complex | 3 Formule Mono-Concentrate a Utilizzo Ciclico | Altamente Biodisponibili | In flaconcini monodose bifasici
Il tappo serbatoio racchiude e protegge i Complessi Vitaminici Puri L'ampolla sottostante contiene un'emulsione fluida con olio di mandorle dolci e complessi idratanti, attivanti e illuminanti La mono-concentrazione delle vitamine A | C | E | in 3 formule distinte permette di veicolare alla pelle gli alti dosaggi vitaminici usati nella medicina estetica. I booster veicolanti garantiscono un elevato assorbimento cutaneo, senza necessità di aghi. I complessi illuminanti, con polvere di perla e diamante, riflettono e modulano in maniera omogenea la luce, mascherando le imperfezioni cutanee e facendo risplendere la naturale bellezza del volto.
Articolo basato su prove sottoposto a revisione scientifica dal Team Ricerca e Sviluppo X115® . La bibliografia è consultabile cliccando sui riferimenti numerici al termine delle frasi. Con il supporto degli studi scientifici e l’esperienza maturata nella ricerca antiaging per i cosmetici e integratori X115® , ci impegniamo a offrirti informazioni affidabili e accurate, basate su prove accessibili e verificabili. La nostra mission è affiancarti nel viaggio verso la salute, la bellezza e il benessere, offrendoti informazioni utili e prodotti altamente efficaci.
A proposito dell'Autore:
Laureato con lode in Scienze Motorie, nel 2005 fonda my-personaltrainer.it, oggi punto di riferimento in Italia per salute, benessere e alimentazione sana. Dopo gli studi in scienze e tecnologie dei prodotti dietetici, erboristici e cosmetici, dal 2011 si occupa dello sviluppo dei prodotti nutricosmetici X115®. Nel 2025 pubblica “
La salute al contrario ”, un libro che promuove il ruolo centrale dello stile di vita nella prevenzione delle malattie e denuncia le derive di un sistema sanitario sempre più orientato a “curare a ogni costo” anziché a promuovere la vera salute.
Latest posts by Dr. Gilles Ferraresi
(see all )
Scarica Gratis il Libro X115® sul Collagene
Una guida pratico-scientifica, informativa e stimolante, per scoprire il collagene, le sue proprietà e i suoi benefici per la salute e la bellezza della pelle.
Download gratuito